GOZZO MULTINODULARE (STRUMA)
Il gozzo multinodulare della tiroide (struma tiroideo) è una delle più frequenti patologie tiroidee, e consiste in un aumento volumetrico della tiroide, che può essere a sua volta di tipo diffuso (gozzo diffuso) o nodulare (gozzo uninodulare o multinodulare).
EPIDEMIOLOGIA
L’incidenza del gozzo dipende molto dalla quantità di iodio introdotto con la dieta nella popolazione. Il fabbisogno giornaliero è 150 μg (per gli adulti), 90 μg (nei neonati) e 200 μg (nella gravidanza). Lo iodio viene assunto con l’alimentazione (sale, pesce) e con l’aria, ed in base alla sua disponibilità nell’ambiente si possono distinguere aree con discreta disponibilità di iodio (aree non endemiche per gozzo) ed aree con scarsa disponibilità di iodio (aree di endemia gozzigena). Le aree con maggior carenza iodica sono le zone di alta montagna (Alpi, Ande, Himalaia) e sono divise in diversi gradi di gravità in base allo iodio presente nelle urine (iodiuria) e alla prevalenza del gozzo. L’incidenza del gozzo nelle aree di endemia di grado lieve può variare dal 10 al 30% della popolazione; nelle aree di grado moderato dal 20 al 50%; nelle aree di endemia grave fino a più del 50%. Nelle regioni non endemiche per gozzo, invece, la prevalenza del gozzo multinodulare è inferiore al 4%. Tuttavia, i risultati delle più moderne tecniche ultrasonografiche (ecografia) e degli studi autoptici, hanno dimostrato che questi dati sottostimano la reale incidenza del gozzo. (Prenota una visita endocrinologica).
EZIOLOGIA
Il gozzo multinodulare è il risultato di un cronico e continuo stimolo da parte del TSH che induce un ingrandimento (iperplasia) della tiroide.
David Marine, per primo, ha affermato che in seguito alla mancanza di iodio, l’ipofisi produce più TSH nel tentativo di aumentare la captazione tiroidea di iodio e di consentire un normale funzionamento della tiroide.
In seguito alla continua stimolazione da parte del TSH, tuttavia, la tiroide può andare in contro ad iperplasia (quadro istologico di gozzo colloide) e successivamente può evolvere verso una quadro di gozzo multinodulare.
Quando il gozzo è diventato di discrete dimensioni, infine, le capacità funzionali della tiroide possono essere così aumentate che i livelli di TSH possono risultare addirittura leggermente diminuiti.
Alcuni studi, infatti, hanno dimostrato la presenza di bassi livelli plasmatici di TSH in pazienti con gozzo multinodulare; tale reperto può essere spiegato con l’insorgenza di autonomia funzionale da parte di alcuni noduli della tiroide.
Quest’ultima ipotesi è confermata, inoltre, dalla relazione inversa esistente tra i livelli di TSH (dopo TRH) e le dimensioni della tiroide nel gozzo multinodulare non tossico (figura1).
Questi studi, quindi, dimostrano che un gozzo diffuso (generato dallo stimolazione continua del TSH) può evolvere verso uno struma multinodulare in cui uno o più noduli possono successivamente autonomizzarsi sopprimendo il TSH.
I fattori causali del gozzo multinodulare possono essere divisi in:
Fattori primari:
1) Eterogeneità genetica delle normali cellule follicolari
2) Acquisizione di nuove caratteristiche in seguito a replicazione cellulare
3) Anormalità funzionali ed anatomiche del gozzo in fase di crescita
Fattori secondari:
1) Aumento del TSH:
- deficienza di iodio
- dieta ricca di sostanze gozzigene
- difetti nella sintesi degli ormoni tiroidei
2) Altri fattori stimolanti la tiroide
Fattori primari:
1) Eterogeneità genetica delle normali cellule follicolari
.
Le cellule della tiroide (tireociti), sono di origine policlonale, pertanto posseggono differenti qualità biochimiche: diversa capacità di risposta al TSH, differenti capacità di sintesi di ormone tiroideo, di captazione di iodio e di produzione di tireoglobulina. Conseguenza della eterogeneità è il riscontro di differenze nella crescita e nella funzione delle cellule poste nelle varie zone della tiroide: ciò spiega perchè all’interno dello stesso gozzo ci possa essere una enorme differenza di dimensioni, funzione e forma tra i vari follicoli (figura 2).
2) Acquisizione di nuove caratteristiche in seguito a replicazione cellulare .
Le cellule della tiroide replicandosi possono acquisire qualità precedentemente non presenti nella cellula madre: le cellule figlie, per esempio, possono sviluppare una maggior sensibilità al TSH e quindi una maggior predisposizione a crescere.
Il riscontro di alcune mutazioni somatiche nell’adenoma tossico e nelle cellule dei noduli iperfunzionanti del gozzo multinodulare, infatti, sembrano confermare tale ipotesi.
L’alterazione riguarda spesso il gene che codifica per il recettore del TSH, per il quale sarebbero state individuate diverse mutazioni. La mutazione del codone 727 del gene del TSH-recettore è specificatamente associato con lo sviluppo di gozzo multinodulare tossico.
Infine può anche accadere che, nella stessa tiroide, noduli differenti possano avere, nello stesso gene, mutazioni diverse.
3) Anormalità funzionali ed anatomiche del gozzo in fase di crescita.
I follicoli di nuova formazione, possono essere morfologicamente non perfetti, e questo può causare una disomogenea distribuzione degli enzimi tiroidei e un’alterata comunicazione intercellulare. La crescita intra- ed inter-follicolare, quindi, può non avvenire in modo coordinato e simmetrico, ma in modo disordinato ed eterogeneo, configurando il tipico quadro di struma multinodulare.
Fattori secondari:
1) Aumento del TSH:
– deficit di iodio: molti studi indicano che la carenza dell’apporto iodico, o alterazioni del metabolismo dello iodio, possono portare ad un aumento della secrezione di TSH e quindi all’insorgenza di un gozzo.
L’apporto iodico (che per garantire una normale ormonosintesi dovrebbe essere circa 150 microg/die ) è riflesso dall’escrezione urinaria dello iodio. La misura della iodiuria rappresenta pertanto un indice sul quale rapportare il grado di endemia gozzigena che viene definita grave, media o lieve a seconda che la ioduria media della popolazione di una determinata area sia rispettivamente < 25 μ g, tra 25 e 50 μg e tra 50 e 100 μg/g creatinina. Tale dato è confermato dal riscontro dell’esistenza di una relazione inversa tra l’escrezione urinaria di iodio e il volume della ghiandola tiroidea (figura 3).
Poiché gli estrogeni riducono il riassorbimento renale di iodio, si ritiene che questo meccanismo possa responsabile della maggiore incidenza di gozzo nel sesso femminile (con accentuazione nel periodo puberale ed in gravidanza).
- dieta ricca di sostanze gozzigene: solitamente l’effetto della carenza di iodio può essere amplificato da una dieta ricca di alimenti gozzigeni (tiocianati) contenuti nei cavoli, nei broccoli o nella manioca.
– difetti nella sintesi degli ormoni tiroidei: sono stati individuati dei difetti congeniti dell’ormonogenesi che vengono generalmente trasmessi per via ereditaria e che possono spiegare la familiarità talvolta riscontrabile nel gozzo. I principali difetti congeniti sono:
A) difetto di trasporto dello ioduro;
B) difetto della tireoperossidasi (TPO) al quale si può associare sordità percettiva (sindrome di Pendred);
C) difetto dell’accoppiamento delle iodiotirosine;
D) difetto della desiodasi tiroidea;
E) sintesi di iodoproteine anomale diverse dalla tireoglobulina.
I difetti possono essere completi o parziali. Nel caso di difetto completo alla nascita, si può assistere ad un quadro di gozzo con cretinismo, mentre in caso di difetto parziale solitamente compare solo un gozzo con lieve ipotiroidismo.
Spesso la manifestazione clinica dei difetti minori si verifica in quanto la carenza di iodio nella dieta smaschera un difetto genetico sottostante.
2) Altri fattori stimolanti la tiroide:
Numerosi studi, infine, hanno dimostrato che i fattori che possono contribuire ad un aumento volumetrico della tiroide sono molteplici:
– EGF (fattore di crescita epidermoidale): esso sembra stimolare la crescita dei tireociti sebbene riduca contemporaneamente la captazione e l’organizzazione dello iodio.
– IGF (fattore di crescita insulino simile): è stata dimostrata un’azione sinergica con il TSH nella stimolazione della crescita cellulare, sia da parte dell’IFG1 che dell’IGF2.
– FGF (fattore di crescita dei fibroblasti): stimola, in presenza di TSH, il deposito di colloide nella tiroide.
Altre sostanze che probabilmente hanno un ruolo nello sviluppo del gozzo multinodulare sono: acetilcolina, norepinefrina, prostaglandine, VIP ed altre citochine; non è chiaro, tuttavia, l’esatto ruolo che svolgono in questo processo.
Per completezza va aggiunto che anche alcuni farmaci come il litio o il fenilbutazone possono contribuire allo sviluppo di un gozzo.
ANATOMIA PATOLOGICA
L’anatomia patologica della ghiandola varia a seconda della fase di sviluppo del gozzo.
Inizialmente vi è un ingrandimento diffuso, simmetrico della ghiandola (gozzo diffuso), in cui i follicoli sono delimitati da cellule colonnari affollate.
Se poi l’apporto dietetico di iodio aumenta o le richieste diminuiscono, l’epitelio follicolare va incontro ad involuzione formando una ghiandola con abbondante colloide (gozzo colloide).
Il continuo ripetersi di episodi di stimolazione ed involuzione può portare ad un ingrandimento irregolare della tiroide.
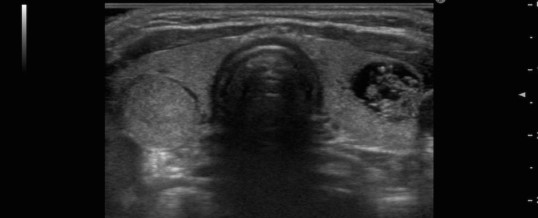
Il gozzo multinodulare macroscopicamente si presenta con una struttura deformata dalla presenza di plurime formazioni nodulari che possono essere estremamente variabili per dimensioni (da pochi mm fino ad alcuni cm), margini (ben definiti o molto sfumati) e struttura (solidi, gelatinosi, colloidali o emorragici) (figura 4).
Le alterazioni involutive nell’ambito di uno struma sono molto frequenti soprattutto nei gozzi di vecchia data e comprendono: aree di fibrosi e di emorragia, calcificazioni e trasformazioni cistiche.
L’aspetto microscopico comprende follicoli delimitati da epiteli piatti, inattivi ed aree di ipertrofia-iperplasia associati a manifestazioni involutive.
Nel contesto di un gozzo multinodulare, infine, si può osservare anche la presenza di tessuto tiroideo normale nello spazio fra i noduli.
La presenza di infiltrato linfocitario, invece, è più evidente nei gozzi in cui è più probabile lo sviluppo di un processo autoimmune. (Prenota una visita endocrinologica).
STORIA NATURALE
Il gozzo si può evidenziare durante l’adolescenza in quanto un lieve ingrandimento della tiroide può essere dovuto alla variazione del metabolismo ormonale tipico di questo periodo.
Successivamente il fenomeno regredisce ma in alcuni casi (soprattutto nelle donne) può persistere o divenire nuovamente evidente nella gravidanza o in altri periodi della vita.
Questo processo, ben documentato nelle zone di endemia gozzigena, è meno evidente nei casi di gozzo sporadico.
I pazienti con gozzo multinodulare si recano più frequentemente dal medico per il riscontro di un incremento volumetrico della tiroide in assenza di sintomi.
Solo quando il gozzo raggiunge dimensioni maggiori può determinare dei sintomi compressivi: tosse, difficoltà a respirare (dispnea) (prenota una visita pneumologica), a deglutire (disfagia), senso di peso al collo, e solo più raramente disfonia (da compressione del nervo laringeo ricorrente) (prenota una visita otorinolaringoiatrica).
Questo solitamente vale per il gozzo multinodulare non tossico, cioè un gozzo in cui la tiroide ha una funzione ancora nella norma.
Nel caso in cui si sviluppi un ipertiroidismo (per lo sviluppo di aree funzionalmente autonome) o un ipotiroidismo (per il prevalere di aree fredde o per l’instaurarsi di un processo infiammatorio autoimmune) alla sintomatologia compressiva potrà aggiungersi quella dell’ipertiroidismo o dell’ipotiroidismo rispettivamente.
Con il passare del tempo, infatti, alcuni noduli possono assumere un’autonomia funzionale ed il paziente con gozzo può passare da un eutiroidismo ad un quadro di ipertiroidismo.
Solitamente sono necessari circa 15 anni per lo sviluppo di ipertiroidismo; pertanto, quanto più un gozzo è di vecchia data, tanto maggiore è la possibilità di sviluppare un’autonomia funzionale.
Non è raro, infatti, che un nodulo caldo cominci a funzionare più del dovuto e, sopprimendo la secrezione ipofisaria di TSH, finisca per inibire l’attività del tessuto tiroideo residuo (figura 5).
E’ oramai appurato che lo sviluppo improvviso di ipertiroidismo in un gozzo multinodulare di lunga data può essere scatenato dall’introduzione di una eccessiva quantità di iodio.
E’ molto più improbabile, invece, che in uno struma si sviluppi un ipotiroidismo come conseguenza di un processo autoimmune.
Da non trascurare, invece, la possibilità di sviluppo di un carcinoma tiroideo.
Infatti la presenza di microlesioni con caratteristiche di carcinomi è stata dimostrata nel 4-17 % di gozzi multinodulare; quasi sempre si tratta della variante di carcinoma papillare.
Altri studi, tuttavia, hanno riportato che focolai di adenocarcinoma papillare sono riscontrabili nel ben 13% delle tiroidi asportate per qualsiasi motivo. Nonostante ciò, l’asportazione chirurgica di un gozzo multinodulare di vecchia data al fine di prevenire la diffusione della patologia maligna non è consigliata in quanto:
a) non tutte le lesioni che soddisfano i criteri istologici di neoplasia sono effettivamente maligne
; b) è stato dimostrato che il rischio di sviluppare un carcinoma in un gozzo multinodulare non è elevatissimo
; c) l’asportazione chirurgica della tiroide presenta sempre delle complicanze e dei rischi di morbilità che vanno valutati. (Prenota una visita chirurgica).
CLINICA
Molti dei sintomi del gozzo sono dovuti alla presenza di una massa nel collo che comprime le strutture adiacenti. Ci può essere disfagia, tosse, raucedine e disfonia; quest’ultima, tuttavia, è di più raro riscontro nello struma essendo spesso secondaria all’infiltrazione del nervo laringeo ricorrente da parte di un carcinoma della tiroide. Evento ancora più raro è la compressione dei gangli simpatici superiori che può causare una sindrome di Horner (ptosi, miosi, enoftalmo) (prenota una visita oculistica). A volte un gozzo di discrete dimensioni può trascinarsi verso il basso in virtù del suo stesso peso immergendosi nella parte superiore del mediastino rendendone difficile l’individuazione all’esame obiettivo (gozzo retrosternale o gozzo immerso). Evento ancora più raro è il raggiungimento del mediastino inferiore e del diaframma con compressione della vena cava superiore, dell’aorta o deviazione della trachea (sindrome mediastinica). Va ricordato, infine, che non vi è sempre stretta relazione fra le dimensioni del gozzo e l’entità dei sintomi che, invece sono spesso legati alla sensibilità individuale dei pazienti. Qualora si sviluppi un ipertiroidismo, ai sintomi compressivi vanno aggiunti i sintomi dell’ipertiroidismo. I sintomi dell’ipertiroidismo sono: tachicardia, cardiopalmo, labilità emotiva, accelerata motilità intestinale e sudorazione profusa; manca l’oftalmopatia infiltrativa tipica del morbo di Basedow. E’ indispensabile, pertanto, differenziare un gozzo tossico da un morbo di Basedow in quanto rappresentano due entità chiaramente distinte dal punto di vista eziopatogenetico e terapeutico. (Prenota una visita endocrinologica).
DIAGNOSI
La diagnosi di gozzo multinodulare è basata essenzialmente su: A) Esame obiettivo: consente di palpare la tiroide e di valutarne le dimensioni, la consistenza e l’eventuale presenza di noduli. Una tiroide di volume aumentato con più noduli ci indirizza verso la diagnosi di gozzo multinodulare. L’esame obiettivo, inoltre, può essere di ausilio nell’indirizzarci verso la natura maligna di una lesione se la crescita nodulare è particolarmente rapida, se i noduli sono adesi alle altre strutture del collo o se compare un interessamento dei linfonodi laterocervicali o disfonia da infiltrazione neoplastica del nervo ricorrente. B) Esami di laboratorio: importante è la valutazione degli ormoni tiroidei in base ai quali è possibile distinguere il gozzo non tossico (FT3, FT4, TSH nella norma), il gozzo in ipertiroidismo subclinico (FT3 e FT4 nel range di normalità ma TSH leggermente soppresso in paziente asintomatico) e il gozzo tossico (alti valori di FT3 e FT4 e TSH soppresso in paziente spesso sintomatico). A volte può essere anche utile ricercare la presenza di autoanticorpi antitireoglobulina (anti-TG), anti tireoperossidasi (anti-TPO), antiTSH-recettore. C) Ecografia: questa metodica consente una descrizione anatomica più dettagliata dello struma tiroideo. Il sempre crescente utilizzo dell’ecografia nello studio della patologia tiroidea ha determinato un aumento del riscontro di patologia nodulare della tiroide (prenota un’ecografia tiroidea). Infatti lo studio ecografico effettuato in pazienti con un singolo nodulo palpabile rivela la presenza di altri noduli nel 30 % dei casi. L’ecografia tiroidea, infatti, può individuare anche noduli di pochi millimetri, e può descriverne le caratteristiche più importanti (dimensioni, calcificazioni, margini, elementi cistici etc.). Nell’iperplasia semplice la tiroide è aumentata globalmente, con aumento di tutti i diametri. La struttura parenchimale è omogenea con normale visibilità dei vasi parenchimali alla valutazione ecocolorDoppler. Nel gozzo, invece, sono visibili plurime formazioni nodulari (ipo, iso o iperecogene); i noduli iperecogeni sono solitamente meno frequenti (25%). I criteri ecografici di benignità dei noduli sono: -iso-iperecogenicità dei noduli; -margini regolari delimitati da un alone perferico ipoecogeno che il doppler dimostra corrispondere alla rete vascolare periferica al nodulo; -calcificazioni capsulari sottili a “guscio d’uovo” o intranodulari grossolane “a zolla”. Alcuni studi hanno dimostrato che la presenza di piccole microcalcificazioni all’interno nei noduli aumenta del 29% la probabilità che si tratti di una patologia maligna; tuttavia sono stati descritti anche noduli di grosse dimensioni con microcalcificazioni con caratteristiche di benignità (prenota un ecocolordoppler tiroideo). D) Scintigrafia: consente una valutazione morfo-funzionale della tiroide. Si utilizzano dei radioisotopi che vengono captati dalla tiroide (iodio 123, o Tecnezio99-pertecnato); tuttavia solo lo iodio viene organificato dalla tiroide pertanto fornisce maggiori informazione sulla funzionalità tiroidea rispetto al tecnezio che, invece, fornisce prevalentemente informazioni morfologiche. La scintigrafia permette di distinguere aree fredde (ipofunzionanti) che possono nascondere un tumore e che pertanto richiedono una successiva valutazione con agoaspirato (FNAB) (prenota un agoaspirato tiroideo), ed aree calde (iperfunzionanti), solitamente benigne. Solo una piccola percentuale di noduli caldi, infatti, nasconde un carcinoma (e si tratta spesso di tumori poco aggressivi che originano, in realtà, dalla regione adiacente al nodulo caldo). Va tenuto in mente, tuttavia, che esiste la possibilità che un nodulo caldo alla scintigrafia con tecnezio possa apparire freddo alla scintigrafia con lo iodio. I principali limiti della scintigrafia sono: a) è una metodica bidimensionale e pertanto non è completa nella valutazione morfologica dello struma multinodulare; b) ha un valore limitato nella scelta dei candidati alla chirurgia c) non individua i noduli di piccole dimensioni. Rimane, tuttavia, una metodica utile per la valutazione nel tempo del gozzo multinodulare. E) Agoaspirato (FNAB): è una semplice procedura effettuata con ago sottile per prelevare del tessuto da sottoporre ad esame citologico. L’esperienza dell’operatore consente di ottenere un prelievo adeguato in una alta percentuale di casi. L’agoaspirato è solitamente effettuato sotto guida ecografica ed è l’unico esame dirimente nel distingure la natura maligna di una lesione nodulare: il risultato dell’esame citologico, infatti, potrà essere: non diagnostico, benigno, sospetto o maligno. Il più importante limite dell’agoaspirato è l’inefficacia nella distinzione fra un carcinoma follicolare ed un adenoma follicolare (proliferazione follicolare o TIR3). In questi casi può essere d’aiuto la genetica molecolare ed in particolare Afirma o Thyroseq.(Prenota una visita endocrinologica). E’ oggetto di discussione se nei noduli voluminosi vi sia un maggior rischio di falsi negativi.
TERAPIA
La terapia non è necessaria se l’ingrandimento della tiroide è di modesta entità, se i livelli di TSH sono normali e se il paziente è asintomatico.
Se invece sono presenti sintomi compressivi o problemi estetici, se compare un rapido incremento volumetrico dei noduli o se si sviluppa ipertiroidismo, allora un intervento terapeutico (medico o chirurgico) diviene necessario.
Gozzo multinodulare non tossico:
La terapia medica consiste nel somministrare l’ormone tiroideo a dosi soppressive (TSH <0,2 microUI/ml) o semisoppressive (TSH =0,2-0,5 micrUI/ml); tale approccio può dare buoni risultati in termini di riduzione delle dimensioni del volume tiroideo sia nel gozzo semplice diffuso che nel nodulo singolo.
Tuttavia, lo stato di ipertiroidismo subclinico indotto da dosi soppressive di LT4 ha, come effetti collaterali, l’aumento del lavoro cardiaco ed il peggioramento dello stato di mineralizzazione ossea (osteoporosi).
Nel gozzo multinodulare, invece, l’efficacia della terapia soppressiva è ancora minore in quanto scarsamente efficace nel ridurre le dimensioni dello struma. Inoltre la somministrazione di ormone tiroideo può essere anche potenzialmente dannosa se il gozzo contiene già, al suo interno, aree di autonomia funzionale.
In sintesi fanno optare verso una terapia soppressiva:
-la giovane età, lo stato premenopausale, il sesso maschile, l’assenza di cardiopatie; (prenota un ecocradiogramma).
-la benignità clinica e/o citologica del gozzo;
-un TSH pre-terapia >1 micrUI/ml;
-le dimensioni del nodulo < 3 cm;
-assenza di aree di autonomia funzionale.
Gozzo multinodulare tossico:
Mentre la terapia medica può rappresentare la terapia definitiva in un discreto numero di casi nel gozzo diffuso (morbo di Basedow), nella patologia nodulare tossica (nodulo singolo o gozzo multinodulare) essa va considerata come semplice preparazione alla definitiva terapia ablativa (chirurgica o medica con radioiodio).
Le tionamidi (metimazolo e propiltiouracile), sono i farmaci tireostatici più usati.
Essi agiscono inibendo l’azione della tireoperossidasi e riducendo la sintesi di nuovo ormone tiroideo.
Inoltre il propiltiouracile (a differenza del metimazolo), inibisce l’attività desiodasica periferica bloccando la conversione di T4 in T3 nei tessuti extratiroidei.
Un ultimo meccanismo d’azione delle tionamidi, infine, sembra essere anche di tipo immunosoppressivo.
Se il propiltiouracile ha il vantaggio del blocco della conversione periferica, il metimazolo ha un’emivita sensibilmente più lunga (4-6 h vs 75 min) e quindi una durata d’azione più prolungata.
Ne deriva che il metimazolo è 10 volte più potente del propiltiouracile.
Non ci sono sostanziali vantaggi nell’uso del propiltiouracile rispetto al metimazolo se si escludono tre condizioni: la crisi tireotossica (in cui la rapida diminuzione della T3 può essere vantaggiosa), la gravidanza e l’allattamento (in virtù del minor passaggio del PTU attraverso la placenta ed il latte).
Il trattamento con tionamidi trova essenzialmente indicazione nel trattamento di preparazione alla terapia ablativa (chirurgica o radiometabolica) nel gozzo tossico uni o plurinodulare. L’obbiettivo è il raggiungimento di un eutiroidismo funzionale, utile affinché la terapia ablativa avvenga senza rischi.
Tra gli effetti collaterali dei tionamidi: agranulocitosi, epatotossicità e sindromi lupus-like.
I beta-bloccanti (propanololo, metoprololo, atenololo) vengono usati, in associazione ai tionamidi, per il controllo dei sintomi adrenergici come la tachicardia, il cardiopalmo e i tremori. Inoltre sono particolarmente utili nella preparazione alla terapia chirurgica.
La terapia ablativa medica con I-131 (radio-iodio) può essere presa in considerazione quando vi siano controindicazioni all’intervento ablativo chirurgico e nei pazienti anziani.
Questa terapia induce una riduzione del volume della tiroide in tutti i pazienti anche se in modo non totale come con la chirurgia.
Può indurre, però, l’insorgenza di ipotiroidismo in una percentuale di casi variabile dal 25 al 100% dopo un certo periodo di anni, mentre nel periodo immediatamente successivo alla somministrazione di radioidio può causare tireotossicosi.
Per prevenire questa situazione infatti, si usa somministrare farmaci tireostatici già qualche settimana prima della somministrazione di radioidio oppure β-bloccanti nei giorni successivi alla terapia con I-131.
Persino nei gozzi di notevoli dimensioni la terapia radioablativa può essere molto efficace nel ridurre la sintomatologia e nel rallentare la crescita del gozzo.
Una nuova opzione terapeutica è data dalla termoablazione con laser o radiofrequenze.
La terapia ablativa chirurgica (prenota una visita chirurgica), invece, trova indicazione (oltre che nella certezza o nel sospetto citologico di patologia tumorale) in questi casi:
-segni clinici/radiologici di compressione delle strutture del collo e/o del mediastino;
-dimensioni di un nodulo superiore a 3 cm o incremento delle dimensioni di un nodulo durante la terapia TSH soppressiva;
-gozzo multinodulare tossico con noduli funzionalmente autonomi;
-problemi estetici.
L’intervento va effettuato dopo adeguata preparazione con tionamidi in paziente eutiroideo.
A questo punto la scelta dell’intervento da adottare può variare tra:
– lobectomia: asportazione di un lobo tiroideo e dell’istmo;
– tiroidectomia subtotale: asportazione bilaterale di più di metà della tiroide in ogni lato e dell’istmo;
– tiroidectomia near total: lobectomia totale e istmectomia lasciando meno del 10% della porzione postero-laterale del lobo controlaterale;
– tiroidectomia totale: rimozione di ambedue i lobi e dell’istmo.
La lobectomia si effettua nei casi lesione unica o multinodulare monolaterale.
La near total si effettua nei giovani con gozzo normofunzionante o quando il rischio di complicanze paratiroidee o ricorrenziali è più alto.
La tiroidectomia totale, invece, va effettuata nei gozzi iperfunzionanti, nei gozzi intratoracici e nei casi di tumore.
Dopo la terapia chirurgica il paziente ipotiroideo va sottoposto a terapia sostitutiva con levo-tiroxina. (Prenota una visita chirurgica).
Prenota una visita specialistica endocrinologica in merito a questo argomento.
Dott. Massimiliano Andrioli
Specialista in Endocrinologia e Malattie del Ricambio
Centro EndocrinologiaOggi, Roma
viale Somalia 33A, Roma
tel/fax 0686391386
cell 3337831426
Studio EndocrinologiaOggi, Lecce
via Ruffano 4, Casarano (Lecce)
tel/fax 0686391386
cell 3337831426
Bibliografia
1. Faglia G. Malattie del sistema Endocrino e del Metabolismo. 1997;119-121.
2. Gharib TGH, Thyroid incidentalomas: management approaches to nonpalpable nodules discovered incidendtally on thyroid imaging. Ann Int Med 126:226-231,1997.
3. Marine D: Etiology and prevention of simple goiter. Medicine 3:453,1924.
4. Beckers C, Cornette C: TSH production rate in nontoxic goiter. J Clin Endocrinol Metab 32:852,1971.
5. Dige-Petersen H, Hummer L: Serum thyrotropin concentrations under basal conditions and after stimulation with thyrotropin-releasing hormone in idiopathic non-toxic goiter. J Clin Endocrinol Metab 44:1115,1977.
6. Smeulers J, Docter R, Visser TJ, Hennemann G: Response to thyrotrophin-releasing hormone and triiodothyronine soppressibility in euthyroid multinodular goitre. Clin Endocrinology 7:389,1977.
7. Peter HJ, Gerber H, Studer H, Smeds S: Pathogenesis of heterogeneity in human multinodular goiter. J Clin Invest 76:1992,1985.
8. Masini-Repiso AM, Cobanillas AM, Bonaventura M, Coleoni AH. Dissociation of thyrotropin-dependent enzyme activities, reduced iodide transport, and preserved iodide organification in nonfuntioning adenoma and multinodular goiter. J Clin Endocrinol Metab 79:39,1994.
9. Holzapfel AP, Fuhrer D, Wonerow P, et al. Identification of constitutively activating somatic thyrotropin receptor mutations in a subset of toxic multinodular goiters. J Clin Endocrinol Metab 82:4292-4233,1997
10. Tassi V, Di Cerbo A, Porcellini A, Papini E, Cisternino C, et al. Screening of thyrotropin receptor mutations by fine-needle aspiration biopsy in autonomous functioning thyroid nodules in multinodular goiters. Thyroid 9:353-357,1999.
11. Krohn K, Wohlgemuth S, Gerber H, Paschke R. Hot microscopic areas of iodine-deficient euthyroid goitres contain constitutively activating TSH receptor mutations. J Pathol 192:37-42,2000
12. Koutras DA, Alexander WD, Buchanan WW, Crooks J, Wayne JE: Stable iodine metabolism in non-toxic goitre. Lancet 2:784,1960.
13. Langer P: Antithyroid action in rats of small doses of some naturally occurring compounds. Endocrinology 79:1117,1966.
14. Cheng YL, Birman KD, Schaudies RP, Ahmann AJ, d’ Avis J, Geelhoed GW, Wartofsky L: Effects of epidermal growth factor on thyroglobulin and adenosine 3′,5′-monophosphate production by cultured human thyrocytes. J Clin Endocrinol Metab 69:771,1989.
15. Sugenoya A, Masuda H, Komatzu M, Jokojama S, Shimizu T, Fujimori M, Kobajashi S, Iida F. Adenomatous goitre: therapeutic strategy, postoperative outcome, and study of epidermal growth factor receptor. Brit J Surg 79:404,1992.
16. Maciel RM, Moses AC, Villone G, Tramontano D, Ingbar SH: Demonstration of the production and physiological role of insulin-like growth factor II in rat thyroid follicular cells in culture. J Clin Invest 82:1546,1988.
17. Phillips ID, Becks GP, Logan A, Wang JF, Smith C et al. Altered expression of insulin growth factor-1 (IGF-I) and IGF binding proteins during rat hyperplasia and involution. Growth Factors 10:207,1994.
18. Takahashi S-I, Conti M, Van Wyk JJ: Thyrotropin potentiation of insulin-like growth factor-I dependent deoxyribonucleic acid synthesis in FRTL-5 cells: Mediation by an autocrine amplification factor(s). Endocrinology 126:736,1990.
19. Vanelli GB, Barni T, Modigliani U, Paulin I, Serio M, Maggi M, Fiorelli G, Balboni GC. Insulin-like growth factor-I receptors in non-functioning thyroid nodules. J Clin Endocrinol Metab 71:1175,1990.
20. DeVito WJ, Chanoine J-P, Alex S, Fang S-L, Stone S. Effect of in vivo administration of recombinant acidic fibroblast growth factor on thyroid function in the rat: induction of colloid goiter. Endocrinology 131:729,1992.
21. Thompson SD, Franklyn JA, Watkinson JC, et al. Fibroblast growth factors 1 and 2 and fibroblast growth factor receptor 1 are elevated in thyroid hyperplasia. J Clin Endocrinol Metab 83:1336-1341,1998.
GIU
2011
