ORBITOPATIA BASEDOWIANA
Orbitopatia Basedowiana (OB) è il termine che definisce il complesso delle manifestazioni oculari che si osservano frequentemente nei pazienti affetti da una particolare forma di ipertiroidismo (morbo di Basedow) (1). Tuttavia, questa malattia oculare può svilupparsi, seppur molto più raramente, anche in pazienti con affetti ad ipotiroidsmo (tiroidite cronica autoimmune di Hashimoto) o, addirittura, in pazienti senza apparenti alterazioni tiroidee (cosiddetta oftalmopatia basedowiana isolata o Euthyroid Graves’ Disease) (Tabella 1). Trattasi di una patologia con patogenesi autoimmune.
EPIDEMIOLOGIA
Come illustrato nella Tabella 1, l’ orbitopatia basedowiana, almeno nelle sue forme clinicamente rilevanti, è una malattia piuttosto rara, che può insorgere in qualunque età della vita, anche se vi sono due picchi prevalenti, nella 5° e 7° decade (Tabella 1). Nei pazienti basedowiani, un coinvolgimento oculare è clinicamente rilevabile in circa la metà dei casi, anche se per lo più si tratta di forme lievi e tendenzialmente autolimitantesi. In realtà, la storia naturale della malattia non è del tutto conosciuta, anche se si ritiene che la malattia possa spegnersi in un periodo molto variabile, da alcuni mesi a 1-2 anni. Nei pazienti senza apparenti segni di oftalmopatia, le indagini strumentali (TAC, RMN o ecografia delle orbite) spesso mettono in evidenza, segni subclinici di interessamento oculare, come, ad es., un lieve aumento del volume dei muscoli extraoculari o del tessuto fibroadiposo orbitario. Solo nel 3-5% dei casi l’ orbitopatia basedowiana assume caratteri di gravità tali da rendere necessari, come illustrato più avanti, trattamenti aggressivi (1). (Prenota una visita endocrinologica).
I motivi per i quali in questa minoranza di pazienti la malattia acquisisca caratteri di particolare gravità non sono conosciuti. Occorre, tuttavia, menzionare che anche le forme lievi di orbitopatia basedowiana sono responsabili di un marcato peggioramento della qualità della vita di questi pazienti, che tendono ad isolarsi, a non socializzare, a sentirsi malati e meno efficienti (2). L’ orbitopatia basedowiana è più frequente nel sesso femminile, ma il rapporto donna/uomo si riduce man mano che si passa dalle forme lievi alle forme più severe: in altre parole, è relativamente più facile che nell’uomo si sviluppino forme gravi di orbitopatia basedowiana (Tabella 1). L’interessamento oculare è prevalentemente bilaterale, ma può essere monolaterale e, comunque, molto spesso, asimmetrico: i motivi per cui si possono avere forme monolaterali o asimmetriche sono ignoti. Negli ultimi decenni sembra esserci una riduzione della incidenza dell’ orbitopatia basedowiana in generale e, soprattutto delle forme gravi (3). Ciò è almeno in parte il risultato di una più tempestiva diagnosi e terapia sia dell’ipertiroidismo che delle forme iniziali di orbitopatia basedowiana, frutto di una migliore interazione e collaborazione tra endocrinologi e oculisti. Un altro fattore che potrebbe aver contribuito alla riduzione della incidenza dell’ orbitopatia basedowiana è la diminuzione del tabagismo osservata in molti paesi occidentali. Il fumo di sigaretta è, infatti, un importante fattore di rischio per lo sviluppo dell’ orbitopatia basedowiana e, soprattutto, delle forme gravi della malattia oculare (4): la prevalenza di fumatori è nettamente più alta nei pazienti oftalmopatici che nei basedowiani senza oftalmopatia o nei pazienti con altre tireopatie (autoimmuni o non autoimmuni, iperfunzionanti o normofunzionanti) (5) (Tabella 1). I meccanismi attraverso i quali il fumo possa influenzare l’andamento e la gravità dell’ orbitopatia basedowiana non sono ben noti, ma è possibile che il fumo possa intervenire sui meccanismi di malattia, soprattutto determinando un aumento della produzione di radicali liberi che potrebbero contribuire ad automantenere le reazioni immuni nell’orbita dei pazienti oftalmopatici (v. paragrafo sulla Patogenesi) (6).
PATOGENESI
E’ comunemente accettato che l’oftalmopatia sia una malattia di origine autoimmune, alla quale contribuiscono fattori endogeni (fattori genetici non ben chiari, genere femminile, età), ma soprattutto fattori esogeni o ambientali (fumo di sigaretta, disfunzione tiroidea, terapia con radioiodio per l’ipertiroidismo): questi ultimi sembrano svolgere un ruolo preponderante nella comparsa della malattia (7) (v paragrafo su Fattori di rischio). (Prenota una visita endocrinologica).
La patogenesi della malattia non è ancora del tutto chiara. L’ipotesi patogenetica prevalente è che il primum movens sia costituito dal riconoscimento, da parte di linfociti T intratiroidei autoreattivi, di uno o più antigeni tiroidei espressi anche a livello orbitario (Tabella 2) (8). I linfociti T autoreattivi raggiungono ed infiltrano l’orbita grazie all’azione di reclutamento svolta dalle molecole di adesione e di homing da parte delle heat shock proteins. A livello orbitario, dopo il riconoscimento dell’antigene condiviso presentato dai macrofagi grazie anche all’espressione di molecole del sistema HLA, si avvia la produzione di citochine, con diverse caratteristiche secretorie (Th-1 o Th-2) a seconda dello stadio della malattia; le citochine favoriscono la differenziazione dei fibroblasti preadipociti in adipociti, la proliferazione dei fibroblasti orbitari, portando, così, ad un incremento del volume del tessuto fibro-adiposo orbitario, e l’aumentata produzione di glicosaminoglicani (o mucopolisaccaridi acidi) (8). Questi ultimi, in virtù della loro idrofilia, attraggono acqua contribuendo alla formazione di edema e, unitamente alla infiltrazione da parte di cellule infiammatorie, all’aumento volumetrico dei muscoli extraoculari. Queste alterazioni istopatologiche sono alla base della comparsa della proptosi, della disfunzione dei muscoli extraoculari, della possibile compressione del nervo ottico, dell’interessamento infiammatorio dei tessuti molli perioculari (9). La continua produzione di citochine contribuisce, attraverso la stimolazione della espressione di HLA-DR, molecole di adesione e heat shock proteins e della proliferazione dei fibroblasti, ad automantenere la malattia.
Come menzionato nella Tabella 2, rimangono irrisolti molti problemi patogenetici. Il primo riguarda la natura dell’antigene condiviso. Il maggiore sospettato è il recettore del TSH (responsabile dell’ipertiroidismo basedowiano), ma altri antigeni, come la tireoglobulina, la tireoperossidasi o antigeni primitivamente espressi nei miociti potrebbero essere coinvolti (1). Non vi sono risposte definitive, ma alcuni interessanti modelli animali in via di sviluppo sembrano avvalorare il ruolo del recettore del TSH (1).
Un altro problema aperto riguarda il bersaglio primario della reazione immune. L’opinione oggi prevalente è che l’antigene riconosciuto sia localizzato sui fibroblasti e/o gli adipociti, mentre i miociti dei muscoli extraoculari potrebbero essere oggetto solo di un danno secondario, che si riflette nella produzione di anticorpi ritrovati in circolo in questi pazienti e sono diretti contro diversi antigeni muscolari (1).
QUADRO CLINICO
Le manifestazioni cliniche dell’oftalmopatia basedowiana sono estremamente variabili, in rapporto alla gravità della malattia (Tabella 3). (Prenota una visita endocrinologica).
Frequenti sono l’arrossamento ed il senso di bruciore, spesso comunemente osservati al risveglio se gli occhi non si chiudono completamente durante la notte a causa del lagoftalmo (incompleta chiusura delle palpebre): ciò comporta, infatti, l’evaporazione del velo lacrimale e la secchezza del bulbo oculare. Molto frequente è la sensazione di avere un corpo estraneo nell’occhio, spesso riferito come un granello di sabbia. Vi può essere dolore, sia spontaneamente che con i movimenti degli occhi: il/la paziente riferisce la sensazione di qualcosa che tira o spinge da dietro l’occhio. Vi è spesso un eccesso di lacrimazione, ma, al contrario, può essere riferita anche una certa secchezza dell’occhio. Il coinvolgimento dei muscoli extraoculari e la loro disfunzione può causare un alterato movimento degli occhi, con perdita della visione binoculare singola e comparsa di diplopia (sdoppiamento delle immagini, che può essere verticale o orizzontale), uno dei disturbi più invalidanti di questa malattia. La diplopia può essere intermittente, quando compare solo in condizioni particolare (ad es., quando si è stanchi), incostante, quando è sempre presente, ma solo nelle posizioni estreme dello sguardo (verso l’alto, l’alto-esterno, l’esterno), costante, quando è presente in tutte le posizioni dello sguardo, incluse la posizione primaria e, talora, anche la posizione di lettura. Il/la paziente può riferire anche un annebbiamento (o vera riduzione) della vista, spesso semplicemente espressione dell’eccesso di lacrimazione, ma talora indice di un’iniziale compromissione del nervo ottico (neuropatia ottica compressiva).
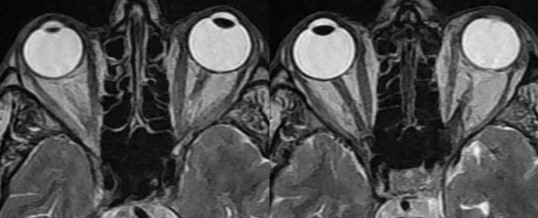
Tra i segni più caratteristici della malattia (Tabella 3) vi è la protrusione dei globi oculari (proptosi o esoftalmo) che può essere misurata con l’esoftalmometro di Hertel o con la TAC o la RMN. La diagnostica per immagini evidenzia anche sia l’incremento del tessuto fibro-adiposo retrobulbare sia l’incremento volumetrico dei ventri dei muscoli extraoculari estrinseci (con caratteristico risparmio delle inserzioni tendinee): vi sono forme di oftalmopatia in cui prevale l’incremento del tessuto fibro-adiposo, altre nelle quali è dominante l’ingrossamento muscolare. Quest’ultimo può causare una compressione del nervo ottico, più evidente nella porzione posteriore dell’orbita. (Prenota una visita oculistica).
FATTORI DI RISCHIO
L’ orbitopatia basedowiana deriva da una complessa interazione tra fattori endogeni ed esogeni (ambientali): questi ultimi vengono oggi considerati di fondamentale importanza sia per lo sviluppo che per la progressione della malattia oculare (10). I fattori di rischio sicuramente identificati sono: il fumo di sigaretta, la disfunzione tiroidea e la terapia dell’ipertiroidismo con radioiodio (1). Al ruolo del fumo di sigaretta si è già fatto cenno nel paragrafo sull’epidemiologia dell’OB. E’, dunque, buona norma, come misura di prevenzione almeno parziale, incoraggiare fortemente i pazienti oftalmopatici ad astenersi dal fumo (Figura 1). Per quanto concerne la disfunzione tiroidea, sia l’ipertiroidismo che l’ipotiroidismo possono essere associati con la comparsa o il peggioramento dell’ orbitopatia basedowiana (1). Ciò si verifica verosimilmente attraverso l’attivazione del recettore del TSH e la conseguente esacerbazione delle reazioni autoimmuni responsabili della malattia oculare. In un paziente oftalmopatico è, dunque, estremamente importante attuare un pronto ed efficace controllo della disfunzione tiroidea (Figura 1) con gli antitiroidei di sintesi nel caso dell’ipertiroidismo, con la L-tiroxina nel caso dell’ipotiroidismo (1).
Mentre né la terapia con antitiroidei, né la tiroidectomia sembrano influenzare la storia naturale dell’ orbitopatia basedowiana, la terapia con radioiodio può causare la progressione dell’ orbitopatia basedowiana (eccezionalmente la comparsa de novo) della malattia oculare (11): ciò si verifica in circa il 15% dei casi, spesso in maniera transitoria, ma non per questo trascurabile. Come indicato nella Figura 2, sono stati identificati molti fattori che aumentano questo rischio: essi includono la presenza di un coinvolgimento oculare prima del trattamento radiometabolico, il fumo di sigaretta, la gravità dell’ipertiroidismo, la non tempestiva correzione dell’ipotiroidismo post-radioiodio, la presenza di elevati titoli di anticorpi anti-recettore del TSH (1). E’ importante sottolineare che il fatto che il radioiodio possa avere questo effetto indesiderato a livello oculare non costituisce una controindicazione al suo impiego come efficace cura definitiva dell’ipertiroidismo. Infatti, la concomitante e relativamente breve somministrazione di dosi moderate di glucocorticoidi per via orale non solo previene questa possibile progressione, ma ha anche effetti curativi sulle manifestazioni oculari preesistenti al trattamento radiometabolico (Figura 1) (12). (Prenota una visita oculistica).
TERAPIA
Solo una piccola parte dei pazienti oftalmopatici necessita di un trattamento aggressivo. Si tratta dei pazienti che hanno forme moderatamente gravi o decisamente gravi di orbitopatia basedowiana. Occorre, pertanto, valutare attentamente la gravità della malattia. Come illustrato nella Tabella 4, i tre parametri più importanti da prendere in considerazione a questo scopo sono: la proptosi, la diplopia e la neuropatia ottica. Già la sola presenza di una marcata proptosi o di una diplopia costante o di una marcata riduzione del visus attribuibile al coinvolgimento del nervo ottico è sufficiente a definire grave l’ orbitopatia basedowiana (1). Tuttavia, anche la combinazione di forme meno gravi delle singole manifestazioni può configurare un quadro di orbitopatia basedowiana grave, nella quale è necessario un trattamento medico o chirurgico (v. paragrafo sulla Terapia) (Tabella 4).
Se l’ orbitopatia basedowiana è grave, per stabilire se il tipo di trattamento debba essere medico o chirurgico, occorre prendere in considerazione un altro parametro fondamentale: l’attività della malattia. Come indicato schematicamente nella Figura 3 e come già brevemente accennato nel paragrafo sull’epidemiologia, l’ orbitopatia basedowiana ha una fase florida, di attività crescente, cui fa seguito un periodo di plateau e, infine, una fase di progressivo spegnimento o inattivazione: questo ciclo ha durata variabile da individuo a individuo, ma, presumibilmente, non superiore ai 12-24 mesi. Quando la malattia esordisce e ha la sua fase florida, cominciano a comparire le manifestazioni cliniche che determinano la gravità dell’ orbitopatia basedowiana (curva di destra della Figura 3). Concomitantemente all’inattivazione dell’ orbitopatia basedowiana, le manifestazioni oculari tendono spontaneamente a regredire, ma questa regressione è inevitabilmente parziale (Figura 3). Due diversi pazienti (A e B nella Figura 3) possono avere lo stesso grado di gravità della malattia oculare, ma gradi diversi di attività. Il paziente A ha una malattia molto attiva, mentre il paziente B ha una malattia inattiva. La differenziazione di queste due situazioni ha importanti ripercussioni terapeutiche. Infatti, come illustrato nella Figura 4, mentre i pazienti con orbitopatia basedowiana attiva sono spesso molto responsivi al trattamento immunosoppressivo ed anti-infiammatorio con steroidi ad alte dosi e/o radioterapia orbitaria, queste terapie sono del tutto inefficaci nei pazienti con orbitopatia basedowiana inattiva, per i quali il trattamento elettivo è quello chirurgico.
Per definire l’attività dell’ orbitopatia basedowiana sono stati proposti metodi diversi (ecografia orbitaria, RMN, octreoscan, determinazione dei glicosaminoglicani urinari), nessuno dei quali ha un’assoluta specificità o è attuabile nella pratica clinica quotidiana. Il metodo più semplice, che, anche se non esente da limitazioni, ha il vantaggio di poter essere attuato da chiunque durante una semplice visita ambulatoriale, è quello di calcolare l’indice clinico di attività (Clinical Activity Score, CAS) (13). Nella sua formulazione rivista, esso prende in considerazione 7 parametri indicativi essenzialmente di una flogosi in atto (Tabella 5) . Assegnando un punto a ciascuna delle manifestazioni presenti, si ottiene un punteggio complessivo che va da 0 (assenza di attività) a 7 (massima attività). Si considera attiva un’ orbitopatia basedowiana con un CAS >3. (Prenota una visita oculistica).
Per riassumere, gravità ed attività sono due diverse caratteristiche che devono essere prese in attenta considerazione nei pazienti oftalmopatici.
La determinazione della gravità serve a identificare i pazienti che necessitano di trattamenti aggressivi; l’attività della malattia aiuta a stabilire se nel singolo paziente sia più appropriato il trattamento medico/radiante o quello chirurgico.
TERAPIA
Nelle forme lievi di orbitopatia basedowiana sono in genere sufficienti misure sintomatiche (Tabella 6) (14). L’uso di lacrime artificiali è utile per controllare i fenomeni irritativi, quello di gel oftalmici al momento di coricarsi è misura valida per ridurre durante le ore notturne l’evaporazione del velo lacrimale in caso di lagoftalmo. L’impiego di lenti scure serve a controllare la fotofobia ed anche a proteggere gli occhi da fattori irritanti come il vento e la polvere. Colliri beta-bloccanti sono utili in caso di aumento del tono oculare e, talora, possono avere una qualche efficacia sulla retrazione palpebrale. L’impiego di diuretici non è di nessuna utilità, ed è molto dubbio che possa essere d’aiuto dormire con la testa lievemente rialzata. Tra le misure “terapeutiche” dell’ orbitopatia basedowiana lieve deve essere ancora una volta ribadito il cogente invito all’astensione dal fumo.
La terapia medica dell’ orbitopatia basedowiana grave si fonda essenzialmente sull’impiego di glucocorticoidi ad alte dosi e della radioterapia orbitaria (15). Entrambi i trattamenti hanno un’azione anti-infiammatoria e verosimilmente modulano anche le reazioni autoimmuni che sono alla base della malattia oculare. Sia gli steroidi che l’irradiazione inibiscono la produzione di glicosaminoglicani da parte dei fibroblasti orbitari. Inoltre i linfociti che infiltrano l’orbita dimostrano una notevole radiosensibilità. Come già accennato precedentemente, l’impiego dei glucocorticoidi e della radioterapia orbitaria è indicato nelle forme gravi e, soprattutto, attive di orbitopatia basedowiana (Tabella 7), mentre nessuno dei due trattamenti è efficace sull’ orbitopatia basedowiana ormai “spenta”. L’associazione dei due trattamenti sembra fornire risultati migliori rispetto al loro impiego isolato. Le manifestazioni oculari che meglio rispondono ai due trattamenti sono le alterazioni infiammatorie a carico dei tessuti molli, la diplopia di recente insorgenza, la neuropatia ottica, mentre la proptosi e la diplopia di lunga durata (alla quale è sottesa una degenerazione fibrotica dei muscoli) sono scarsamente responsive (15). (Prenota una visita oculistica). I glucocorticoidi devono essere impiegati ad alte dosi per poter essere efficaci. Sono state nel tempo utilizzate diverse vie di somministrazione, ma è ormai da alcuni anni evidente che la più efficace forma di somministrazione è per via endovenosa, sotto forma di boli da ripetere ad intervalli settimanali o bisettimanali (16). Le dosi cumulative impiegate variano da centro a centro, ma in considerazione dei possibili effetti collaterali di questo trattamento è consigliabile non superare una dose totale di 6-8 grammi. Per ridurre il rischio di epatotossicità, anche grave, osservato in alcuni casi (17), sembra consigliabile, alla fine del trattamento endovenoso, continuare per alcune settimane la terapia steroidea utilizzando basse dosi di prednisone per via orale. La radioterapia orbitaria, attuata solitamente mediante acceleratore lineare, non ha effetti collaterali rilevanti neppure a lunga distanza, ma la sua azione terapeutica non è così immediata come quella degli steroidi (Tabella 7) (18). L’associazione della terapia steroidea per via endovenosa e della radioterapia orbitaria consente di ottenere risultati favorevoli in oltre l’80% dei casi, anche se la regressione delle manifestazioni oculari è di rado completa.
La terapia chirurgica dell’ orbitopatia basedowiana (orbitotomia decompressiva) consiste nella rimozione di una o più pareti dell’orbita, in maniera da creare uno spazio maggiore a disposizione dell’aumentato contenuto orbitario (1). La chirurgia è indicata soprattutto nelle forme di OB grave e inattiva, con marcata proptosi, ma può essere necessario utilizzarla d’urgenza nelle forme di neuropatia ottica compressiva che non rispondano rapidamente al trattamento steroideo ad alte dosi. Nella maggior parte dei pazienti oftalmopatici si rendono necessari interventi di chirurgia riabilitativa, volti a correggere la residua compromissione dei muscoli extraoculari (chirurgia muscolare) o la permanente retrazione palpebrale inferiore o superiore (chirurgia palpebrale) (1). Sia la chirurgia muscolare che la chirurgia palpebrale devono essere attuate, ove necessario, come ultimo atto, quando l’ orbitopatia basedowiana sia sicuramente e stabilmente inattiva da almeno 6 mesi.
PROSPETTIVE
Nonostante tutti gli sforzi, circa 1/3 dei pazienti oftalmopatici non è, alla fine del follow-up, soddisfatto dei risultati ottenuti con i diversi tipi di trattamento (1). Per questa ragione si sono intensificati gli sforzi volti alla ricerca di nuove forme di trattamento. Poiché sia i linfociti che i fibroblasti orbitari dei pazienti oftalmopatici esprimono recettori per la somatostatina, alcuni studi preliminari hanno valutato il possibile effetto terapeutico degli analoghi della somatostatina (octreotide, lanreotide). Tuttavia, dopo risultati preliminari promettenti, due recenti ed ampi studi randomizzati e controllati hanno documentato con chiarezza la sostanziale inefficacia di questo trattamento (19). E’ comunque possibile che analoghi dotati di maggiore specificità per tutti i sottotipi recettoriali per la somatostatina, come il SOM230 (Tabella 7), possano dimostrarsi più efficaci degli analoghi al momento disponibili. Il ruolo che i radicali liberi potrebbero svolgere nelle reazioni che hanno luogo nell’orbita dei pazienti oftalmopatici (v. Patogenesi) ha fatto ipotizzare un impiego terapeutico degli antiossidanti. I dati disponibili sono assai limitati e del tutto preliminari, non consentendo di prevedere, al momento attuale, un loro ruolo effettivo (Tabella 7). Poiché le citochine sono certamente coinvolte, quanto meno nel mantenimento delle reazioni immuni all’interno dell’orbita, trattamenti anticitochinici, analoghi a quelli utilizzati in altre malattie (ad es., nell’artrite reumatoide), potrebbero essere potenzialmente molto utili, ma risultano, allo stato delle cose, del tutto speculativi per quanto concerne l’ orbitopatia basedowiana (Tabella 7) (20).
Prof. Luigi Bartalena
Dott.ssa Maria Laura Tanda
Dott.ssa Eliana Piantanida
Dott.ssa Adriana Lai
Bibliografia
1. Bartalena L, Pinchera A, Marcocci C. Management of Graves’ ophthalmopathy: reality and perspectives. Endocrine Reviews 2000; 21: 168-199.
2. Wiersinga WM, Prummel MF, Terwee CB. Effects of Graves’ ophthalmopathy on quality of life. Journal of Endocrinological Investigation 2004; 27: 259-264.
3. Perros P, Crombie AL, Kendall-Taylor P. Natural history of thyroid-associated ophthalmopathy. Clinical Endocrinology 1995; 42: 42-50.
4. Bartalena L, Bogazzi F, Tanda ML, Manetti L, Dell’Unto E, Martino E. Cigarette smoking and the thyroid. European Journal of Endocrinology 1995; 133: 507-512.
5. Bartalena L, Martino E, Marcocci C, Bogazzi F, Panicucci M, Velluzzi F, Loviselli A, Pinchera A. More on smoking habits and Graves’ ophthalmopathy. Journal of Endocrinological Investigation 1989; 12: 733-737.
6. Bartalena L, Tanda ML, Piantanida E, Lai A. Oxidative stress and Graves’ ophthalmopathy: in vitro studies and therapeutic implications. Biofactors 2003; 19: 155-163.
7. Wiersinga WM, Bartalena L. Epidemiology and prevention of Graves’ ophthalmopathy. Thyroid 2002; 12: 855-860.
8. Burch HB, Wartofsky L. Graves’ ophthalmopathy: current concepts regarding pathogenesis and management. Endocrine Reviews 1993; 14: 747-793.
9. Bahn RS. Pathophysiology of Graves’ ophthalmopathy: the cycle of disease. Journal of Clinical Endocrinology and Metabolism 2003; 88: 1939-1946.
10. Bartalena L, Marcocci C, Pinchera A. Graves’ ophthalmopathy: a preventable disease? European Journal of Endocrinology 2002; 146: 457-461.
11. Bartalena L, Marcocci C, Bogazzi F, Manetti L, Tanda ML, Dell’Unto E, Bruno-Bossio G, Nardi M, Bartolomei MP, Lepri A, Rossi G, Martino E, Pinchera A. Relation between therapy for hyperthyroidism and the course of Graves’ ophthalmopathy. New England Journal of Medicine 1998; 338: 73-78.
12. Bartalena L, Marcocci C, Bogazzi F, Panicucci M, Lepri A, Pinchera A. Use of corticosteroids to prevent progression of Graves’ ophthalmopathy after radioiodine therapy for hyperthyroidism. New England Journal of Medicine 1989; 321: 1349-1352.
13. Mourits MP, Koornneef L, Wiersinga WM, Prummel MF, Berghout A, van der Gaag R. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. British Journal of Ophthalmology 1989; 73: 639-644.
14. Bartalena L, Marcocci C, Pinchera A. Treating severe Graves’ ophthalmopathy. Bailliere’s Clinics in Endocrinology and Metabolism 1997; 11: 521-536.
15. Bartalena L, Marcocci C, Tanda ML, Pinchera A. Management of thyroid eye disease. European Journal of Nuclear Medicine 2002; 29 (Suppl. 2): S458-S465.
16. Marcocci C, Bartalena L, Tanda ML, Manetti L, Dell’Unto E, Rocchi R, Barbesino G, Mazzi B, Bartolomei MP, Lepri P, Cartei F, Nardi M, Pinchera A. Comparison of the effectiveness and tolerability of intravenous and oral glucocorticoids associated with orbital radiotherapy in the management of severe Graves’ ophthalmopathy: results of a prospective, single-blind, randomized study. Journal of Clinical Endocrinology and Metabolism 2001; 86: 3562-3567.
17. Marinò M, Morabito E, Brunetto MR, Bartalena L, Pinchera A, Marcocci C. Acute and severe liver damage associated with intravenous glucocorticoid pulse therapy in patients with Graves’ ophthalmopathy. Thyroid 2004; 14: 403-406.
18. Bartalena L, Marcocci C, Tanda ML, Rocchi R, Mazzi B, Barbesino G, Pinchera A. Orbital radiotherapy for Graves’ ophthalmopathy. Thyroid 2002; 12: 245-250.
19. Bartalena L, Marcocci C, Pinchera A. Somatostatin analogs for Graves’ ophthalmopathy: do they bounce off like a rubber bullet? Journal of Clinical Endocrinology and Metabolism 2004; 89: 5908-5909.
20. Bartalena L, Marcocci C, Pinchera A. Cytokine antagonists: new ideas for the management of Graves’ ophthalmopathy. Journal of Clinical Endocrinology and Metabolism 1996; 81: 446-448.
GIU
2011
